氯胺酮是世界卫生组织的一种基本药物,被广泛用于不同剂量的镇静、止痛、全身麻醉和治疗难治性抑郁症。虽然科学家们知道它的目标是脑细胞,并观察到它如何影响整个大脑的活动,但他们还不完全知道这两者是如何联系在一起的。一个跨越波士顿地区四家机构的研究小组进行了一项新的研究,利用以前未被认识到的生理细节的计算建模来填补这一空白,并为氯胺酮的作用机理提供了新的见解。
“这项建模工作有助于破译氯胺酮产生改变唤醒状态的可能机制,以及它对治疗抑郁症的治疗效果,”共同资深作者Emery N. Brown说,他是麻省理工学院Picower学习与记忆研究所计算神经科学和医学工程的Edward Hood Taplin教授,也是麻省总医院的麻醉师和哈佛医学院的教授。
来自麻省理工学院、波士顿大学、麻省总医院和哈佛大学的研究人员表示,他们的模型预测可以帮助医生更好地利用这种药物,该模型的预测结果发表在5月20日的《美国国家科学院院刊》上。
该研究的主要作者、麻省理工学院(MIT)的研究科学家埃利·亚当(Elie Adam)说:“当医生们了解他们给药时发生的机制时,他们可能会利用这种机制并操纵它。”他很快将加入哈佛医学院(Harvard Medical School)的教职员工,并在麻省总医院(MGH)成立一个实验室。“他们知道如何增强药物的良好效果,以及如何减轻药物的不良影响。”
堵门
该研究的核心进展涉及生物物理建模,当氯胺酮阻断大脑皮层中的“NMDA”受体时,会发生什么。大脑皮层是发生感觉处理和认知等关键功能的外层。阻断NMDA受体可调节兴奋性神经递质谷氨酸的释放。
亚当说,当NMDA受体调节的神经元通道(或门道)打开时,它们通常会缓慢关闭(就像带液压闭门器的门一样),允许离子进出神经元,从而调节它们的电学特性。但是,受体的通道可以被分子阻断。镁的阻断有助于自然地调节离子流动。然而,氯胺酮是一种特别有效的阻滞剂。
阻断减缓了神经元膜上的电压积聚,最终导致神经元“尖峰”,或向其他神经元发送电化学信息。当电压升高时,NMDA通道变得畅通。电压、尖峰和阻断之间的相互依赖可以使NMDA受体具有比其缓慢的关闭速度更快的活性。该团队的模型比以前的模型更进一步,展示了氯胺酮的阻断和解除阻断如何影响神经活动。
“通常被忽视的生理细节有时可能是理解认知现象的核心,”波士顿大学数学教授南希·科佩尔(Nancy Kopell)说。“NMDA受体的动态对网络动态的影响比以前所认识到的要大。”
通过他们的模型,科学家们模拟了不同剂量的氯胺酮影响NMDA受体如何改变模型大脑网络的活动。模拟的网络包括在皮层中发现的关键神经元类型:一种兴奋型和两种抑制性。它区分了抑制网络活动的“紧张性”中间神经元和对兴奋性神经元反应更多的“相位性”中间神经元。
研究小组的模拟成功地再现了真实的脑电波,这些脑电波是通过脑电图电极在一名志愿者的头皮上测量的,该志愿者接受了不同剂量的氯胺酮,而神经峰值是在接受了类似治疗的动物身上测量的,这些动物植入了电极阵列。在低剂量下,氯胺酮增加了快速伽马频率范围(30-40赫兹)的脑电波功率。在高剂量导致无意识的情况下,这些伽马波周期性地被“下降”状态打断,只有非常慢的频率δ波出现。这种对高频波的重复干扰可以破坏大脑皮层之间的交流,从而破坏意识。
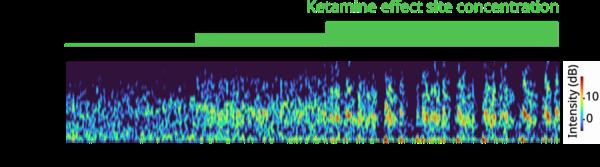 大脑节奏频率随时间变化的频谱图,由该团队的模型预测。在第一次,中等剂量的氯胺酮后,伽马脑节律能量(暖色)出现。然后,随着剂量的增加,伽马节律周期性地中断,留下0
大脑节奏频率随时间变化的频谱图,由该团队的模型预测。在第一次,中等剂量的氯胺酮后,伽马脑节律能量(暖色)出现。然后,随着剂量的增加,伽马节律周期性地中断,留下0
只有非常低频率的波,然后继续。图片由Adam, Kopell, McCarthy等人提供。
上一项下一项
但如何?重要发现
重要的是,通过模拟,他们解释了网络中产生这些动态的几个关键机制。
第一个预测是氯胺酮可以通过关闭某些抑制性中间神经元来解除对网络活动的抑制。模型显示,nmda受体的自然阻断和解阻断动力学可以在神经元没有尖峰时让小电流进入。神经网络中许多处于适当兴奋水平的神经元会依靠这种电流自发地产生尖峰。但当氯胺酮损害NMDA受体的动力学时,它会熄灭电流,使这些神经元受到抑制。在这个模型中,虽然氯胺酮对所有神经元的损害都是一样的,但正是强直性抑制性神经元被关闭了,因为它们恰好处于那种兴奋水平。这释放了其他神经元,兴奋性或抑制性的,从它们的抑制中释放出来,使它们剧烈地飙升,导致氯胺酮的兴奋大脑状态。神经网络增强的兴奋可以使神经元的NMDA受体快速解封(和重新阻断),从而引起脉冲。
另一个预测是,这些爆发与氯胺酮产生的伽马频率波同步。如何?研究小组发现,来自兴奋性神经元的大量神经递质谷氨酸输入刺激了相位抑制性中间神经元,并产生了强烈的尖峰或火焰。当它们这样做时,它们向兴奋性神经元发送神经递质GABA的抑制信号,抑制兴奋性放电,几乎就像幼儿园老师让整个教室兴奋的孩子平静下来一样。这个停止信号,同时到达所有兴奋性神经元,只持续一定时间,最终使它们的活动同步,产生协调的伽马脑波。
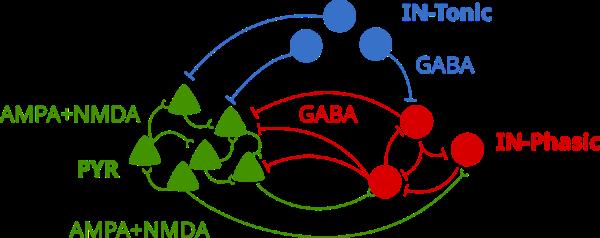 脑网络模型示意图。来
脑网络模型示意图。来
抑制性神经元(蓝色)使用GABA抑制其他类型的神经元。锥体兴奋性神经元和相抑制性神经元(红色)相互刺激,相抑制性神经元反过来又抑制兴奋性神经元。图片由Adam, Kopell, McCarthy等人提供。
上一项下一项
“单个突触受体(NMDA)可以产生伽马振荡,这些伽马振荡可以影响网络级伽马的发现是出乎意料的,”共同通讯作者米歇尔麦卡锡说,她是波士顿大学数学研究助理教授。“这是通过使用NMDA受体的详细生理模型才发现的。这种水平的生理细节揭示了通常与NMDA受体无关的伽马时间尺度。”
那么,高剂量氯胺酮会导致无意识的周期性下降状态呢?在模拟中,由于nmda受体动力学受损,兴奋性神经元的γ频率活动不能持续太长时间。在相间神经元的GABA抑制下,兴奋性神经元基本上耗尽。这就产生了下态。但是,当它们停止向阶段性中间神经元发送谷氨酸后,这些细胞停止产生抑制性GABA信号。这使得兴奋性神经元得以恢复,重新开始一个循环。
抗抑郁联系吗?
该模型做出的另一个预测可能有助于解释氯胺酮如何发挥其抗抑郁作用。这表明氯胺酮增加的伽马活性可以在表达一种叫做VIP的肽的神经元中携带伽马活性。这种肽被发现有促进健康的作用,比如减少炎症,比氯胺酮对NMDA受体的作用持续的时间更长。研究小组提出,当这些细胞在实验中受到刺激时,这些神经元在氯胺酮的夹带下可以增加有益肽的释放。这也暗示氯胺酮的治疗功能可能超出抗抑郁作用。然而,研究小组承认,这种联系是推测性的,需要具体的实验验证。
“了解NMDA受体的亚细胞细节可以导致伽马振荡增加,这是氯胺酮如何治疗抑郁症的新理论的基础,”科佩尔说。
该研究的其他共同作者是Marek Kowalski, Oluwaseun Akeju和Earl K. Miller。
这项工作得到了JPB基金会的支持;Picower学习与记忆研究所;西蒙斯社会大脑研究中心;国立卫生研究院;乔治·j·埃尔鲍姆(George J. Elbaum), 59届,63届硕士,67届博士;咪咪Jensen;Diane B. Greene, 78届;孟德尔Rosenblum;比尔Swanson;以及麻醉倡议基金的年度捐赠者。

